
210项新冠临床试验专家点评来了!
截至目前,尚无新型冠状病毒肺炎(COVID-19)的特效治疗药物,也未发现有明确疗效的预防性药物。因此,为抗击疫情,科学家们迫切需要通过临床试验,筛选出针对新冠肺炎预防或治疗的有效药物。
截至2月22日凌晨1时,《中国科学报》记者从中国临床试验注册中心查询到,自1月23日武汉市金银潭医院申请首个有关COVID-19的临床试验项目以来,如今已经有210项与COVID-19相关的临床试验在国家临床试验注册中心注册。
中医药疗法占相当比例
经过记者统计分析发现:中医药治疗相关的试验46项(占21.9%),中西医结合治疗相关的试验18项(占8.6%),西药治疗相关试验96项(占45.7%),其他类型治疗相关的试验7项(占3.3%),非治疗相关的试验43项(占20.5%)。
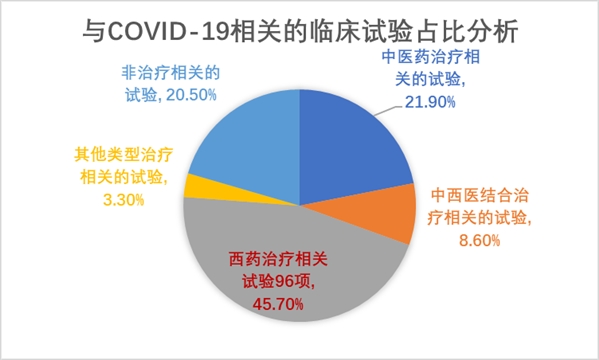
46项中医药治疗COVID-19的临床试验涉及的药物在《新型冠状病毒感染的肺炎诊疗方案》各试行版中也多有涉及。其中口服药物有新冠1号方、新冠2号方、清疫4号、连花清瘟胶囊、八宝丹、金银花汤剂和口服液、双黄连口服液、金银花口服液、固表解毒灵等。注射剂有热毒宁注射液、血必净注射液、参芪扶正注射液、参附注射液。
96项西药方面的临床试验涉及的药物品种比较多,包括抗病毒药物、疫苗、抗体、血浆疗法和细胞疗法等。其中一个聚焦点是抗病毒药,潜力最大的是针对病毒的RNA聚合酶或蛋白酶抑制剂。抗病毒药物中关注度较高的有洛匹那韦/利托那韦、达芦那韦考比司他和瑞德西韦。
另一个聚焦点是免疫治疗。目前认为病毒感染可导致机体的免疫调控失衡,多种细胞因子异常升高,最终造成器官损伤,功能衰竭,引起患者死亡。尤其是严重肺炎通常引发了机体对于外界刺激产生的一种过度免疫,发生细胞风暴。而免疫治疗可以调节患者免疫渡过细胞风暴难关。目前进行的相关临床试验涉及的药物有羟氯喹、托珠单抗、吸入注射用重组病毒巨噬细胞炎性蛋白(vMIP),其中最受关注的为氯喹/羟氯喹和托珠单抗。
此外,细胞疗法也被认为能够调节患者的免疫系统,目前已申报临床试验的细胞疗法有宫血干细胞疗法、脐血间充质干细胞疗法、胎盘生物制剂等。
有意思的是,记者还发现两项有趣的研究:《太极拳对新型冠状病毒肺炎(COVID-19)患者康复期肺功能及生存质量影响的随机对照研究》研究实施负责单位为湖北中医药大学附属新华医院和湖北省中西医结合医院。2.《六字诀结合宽胸理气手法对新型冠状病毒肺炎(COVID-19)重症患者肺功能及生存质量的临床随机对照研究》研究实施负责单位为黄石市中医医院和上海中医药大学康复医学院。
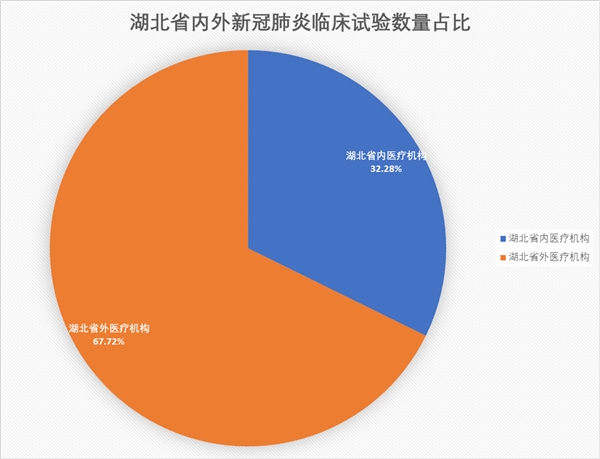
湖北医疗机构申请数量多于1/3
以“湖北”“武汉”“华中”等字样查询,共得到68项相关临床试验(占32.28%),其中,华中科技大学同济医学院附属同济医院共有15项相关临床试验,高居所有医疗机构榜首。
随后,浙江大学医学院附属第一医院(10项)、华中科技大学同济医学院附属协和医院(9项)、武汉大学中南医院(8项)、武汉大学人民医院(8项)、四川大学华西医院(8项)、湖北中西医结合医院(7项)、湖北中医药大学附属新华医院(7项)、成都中医药大学附属医院(7项)等位居其后。
值得一提的是,广州瑞铂茵健康管理咨询有限公司作为唯一一家公司,囊括了6项相关研究。
此外,还有少数县级医院申请了相关试验项目,比如光山县人民医院。
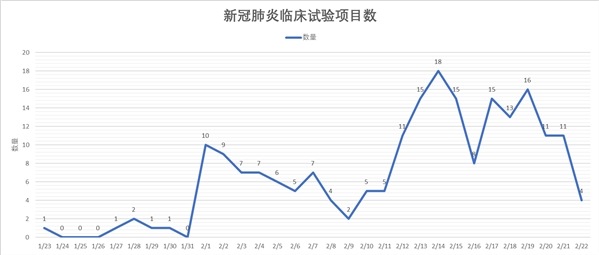
2月14日注册临床项目最多
自1月23日开始,武汉市金银潭医院开始申请首个临床试验,名为“一项评价洛匹那韦/利托那韦和干扰素-α2b联合治疗武汉新型冠状病毒肺炎(COVID-19)住院患者的疗效和安全性随机、开放、空白对照的研究”。随后,直到1月27日,广州医科大学附属第一医院才开始申请第二个临床试验。
其中2月14日,申请的临床试验项目数量最多,高达18项。随后是2月19日(16项),2月17日、2月15日、2月13日均为15项。
对于这210项的临床研究,我们该如何看待?为此,《中国科学报》特别邀请了临床专家、药理学专家、伦理学专家、检验学专家给予点评:
北京医院药学部主任、教授胡欣:
安全性与疗效是急不来的
此次,SARS-CoV-2病毒爆发后,当社会期盼的目光聚焦寻找抗病毒药物时,我们才意识到抗病毒新药其实很少,在抗病毒等传染病领域的研发和投入还很薄弱。
总体来说,本次疫情出现后,医药工作人员与时间赛跑,紧急开展了公共卫生突发状况下的药物研发,迅速展开了多项临床试验。
同时,我们清醒地看到,在还没有有效抗病毒药物的情况下,短期开发一款全新化合物药物是不现实的,安全性与疗效是急不来的,这些临床试验最终能筛选出多少安全有效的药物都是未知数。药物的创新是一个艰苦的过程,我们或许还需要思考,怎样才能建设更好的药物研发的科学预判、部署体系应对这样的危机。
北京协和医院呼吸与危重症医学科主任医师、教授徐凯峰:
不同数据要汇集成新冠肺炎治疗大数据
目前,在ChiCTR和ClinicalTrials.gov两个网站注册的干预性研究超过了120项。这些研究可以分为3大组,1/3是抗病毒治疗,1/3是中医药治疗,1/3是其他研究。
中药研究虽然已经广泛使用于临床,但这次大规模开展正规的前瞻性对照研究也是出乎意料,这表明中医药临床研究普遍接受了现代医学的理念,也会对更科学地评估和推广中医药治疗方法起到积极作用。
诚然,在传染病暴发期间,开展大量的临床研究面临着诸多挑战,但也要以一丝不苟的要求进行,否则所有的努力将付之东流。
我希望,不同研究的数据可以汇集成新冠肺炎治疗大数据,以比较不同治疗方法的获益,最终让临床研究的成果可以第一时间指导抗疫一线。
华中科技大学同济医学院临床药理学教授曾繁典:
不能因情况紧急而放松伦理要求
面对过往不曾见过的新型冠状病毒肺炎患者,临床不确定因素很多,也给任何以此类患者为对象的临床试验带来空前未遇的挑战。面对这种困难局面,我们尤需加强临床试验医学伦理审查,不能因情况紧急而放松伦理要求,力求避免临床试验不当设计导致对患者正常治疗的过多干扰,避免试验中来自主观或客观的偏倚因素造成试验结果难以评价的后果。
此外,一个医疗机构或一个主要研究者承担过多项目,会导致患者个体化治疗的刚需与临床试验的规范要求难以平衡,以致过多方案偏离,试验无果而终。
需要强调的是,临床试验参入者和一线医护人员一定遵守严格的个人防疫措施,这是保证医疗救护和临床试验成功的基础。
徐州医科大学附属医院检验科副主任、教授顾兵:
检验检测新技术的研发与应用研究太少
新冠肺炎的诊断,病原学证据是关键,核酸检测发挥了重要作用。但是,以“检验”“检测”“诊断”为关键词检索发现,目前注册的临床研究中,对新冠肺炎检验检测新技术的研发与应用研究太少,仅为7项,占3.3%。
目前检验检测的主要方法有:核酸扩增(如荧光RT-PCR技术)、基于新冠病毒抗原的检测和抗体的检测(IgG和IgM)、全基因组测序等。检测涉及的标本有:咽拭子、血液、粪便等。最近,钟南山院士团队报道:从尿液中分离到新冠病毒。
针对不同标本、不同方法的检验检测临床需求强烈,而相关研究太少,远远不能满足抗疫的需要,呼吁检验、临床、化学等多学科专家联合进行新冠病毒检测新技术研发,及其临床应用研究,服务抗疫。
南京医科大学第一附属医院主任医师、教授王俊宏
保证生命安全是开展临床试验的前提
疫情暴发以来,大量相关临床注册研究相继开展,尤其值得称道的是中医药方面研究(含中西医结合)占据一半以上。
任何临床研究一定要在保证患者和一线医护人员生命安全的前提下开展。虽然时间紧迫,伦理审核应在尽量缩短流程及时间的前提下做到严格审核,尤其是加强对设计规范性、科学性和合理性方面的把关,避免不合理、不规范,甚至不科学的研究对患者造成二次伤害。
此外,加强对临床试验的随访,随时跟踪研究进展,必要时缩短研究间期,提前终止试验以使更多患者及时获益。
目前,核酸检测是新冠病毒诊断的金标准,但仍存在阳性率低导致漏诊或延迟诊断的情况,今后应有更多研究关注如何提高诊断效能。
北京协和医学院人文和社会科学学院讲师、博士张迪:
急迫心情不能代替严谨的科学设计和伦理规范
面对新冠肺炎疫情,无数研究者都希望尽快攻克难关。这种急迫的心情能够理解,但这些心情不能代替严谨的科学设计和伦理规范。否则,不仅无法获得有价值的科学知识、创造社会价值,更会分散本就有限和紧张的医疗资源、研究资源和资金,而这些都可能妨碍当前患者的救治和对疫情的整体防控。因此,对于开展医学研究的机构而言,其学术委员会和伦理审查委员会应当紧密结合,把握严谨的科学标准,对研究设计、研究者能力和申办方资质进行评估。
对于符合科学标准的伦理学规范研究,无论最后得出阴性还是阳性结果,都应及时公开信息,以加快疫情期间干预的有效调整。
(本报记者冯丽妃亦对本文有贡献)
(来源:中国科学报)
| 分享1 |






